CRISPR/Cas9,这把源自细菌的“基因剪刀”,通过精准切割DNA(即“双链断裂”),开启了基因编辑革命,让作物育种变得更快捷、更高效。然而,这把“神剪”在实际应用中,也面临着几大关键挑战:1.“剪错地方” (脱靶效应): 可能误切非目标位点,影响安全性。2.“剪刀难送达”(递送效率瓶颈): 如何高效、安全地将编辑工具送入目标细胞?3.“识别码限制”(PAM限制): Cas蛋白只在特定DNA序列附近才能工作,大大限制了编辑范围。4.“修复路径不可控” (精准编辑效率低): 依赖细胞自身修复机制,精准插入或替换效率低。这些挑战成为了基因编辑技术,尤其是在棉花等重要作物遗传改良中,走向更广泛应用的关键瓶颈。

2025年6月23日,性爱网
棉花遗传改良团队在Advanced Science杂志在线发表了题为"Enhancing Specificity, Precision, Accessibility, Flexibility, and Safety to Overcome Traditional CRISPR/Cas Editing Challenges and Shape Future Innovations "的综述论文,系统梳理了近年来为克服这些挑战而诞生的突破性技术,提出优化之道。
一、脱靶效应控制策略
CRISPR/Cas9这把“基因魔剪”虽强大,却易“剪错地方”(脱靶效应),阻碍其精准应用。哪些因素介导 CRISPR/Cas9 诱导的脱靶效应?关键诱因有三:遗传变异(GVs):个体基因组变异(如SNP)可能导致设计的gRNA与真实靶点不匹配,或意外产生/破坏PAM识别位点。PAM:Cas9(如SpCas9)有时会“放宽”对PAM序列(如NGG)的要求(接受NAG/NGA等),增加了结合非理想位点的风险。错配耐受性:Cas9酶自身对gRNA与DNA间部分错配的耐受性,是其脱靶的生化基础。
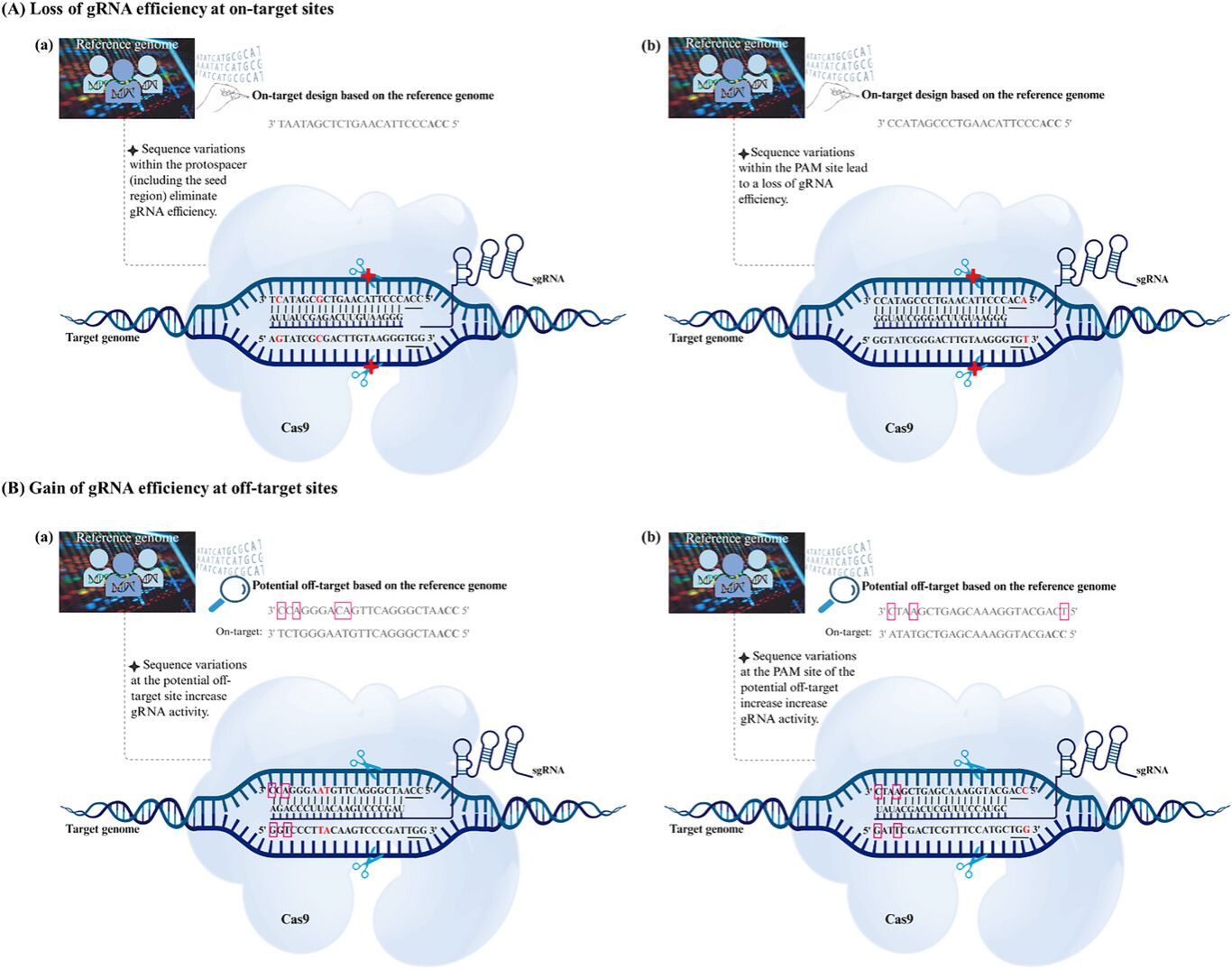
图1 遗传变异(GV)如何影响基于CRISPR的靶向。在(A)中,GV降低了靶向效率:(a) 原型间隔区(protospacer)内的GV破坏了gRNA的结合并阻断了DNA切割;(b) PAM位点中的GV完全消除了gRNA的活性。在(B)中,GV增加了脱靶效应:(a, b) 潜在脱靶位点处的GV产生了新型脱靶位点或PAM序列,分别增强了非预期的gRNA结合和切割。关键的GV用红色高亮显示,彩色方块表示其与参考基因组相比存在错配。竖线代表在靶点处gRNA与DNA配对。
如何打造更精准的“剪刀”?事前精算:全面分析目标基因组变异,利用CRISPOR等工具预测并避开高风险脱靶位点设计gRNA。优化“导航”:优先选择基因组稳定区域设计gRNA,控制GC含量(40%-60%),避免过短sgRNA。升级“剪刀”:采用高保真Cas9变体(如eSpCas9、HiFi Cas9)、Cas9切口酶(nCas9)或替代核酸酶(如Cas12a),显著减少误切。巧用“修复”:理解细胞如何选择修复路径(如易出错的NHEJ vs 精准的HDR)对最终编辑精度至关重要。
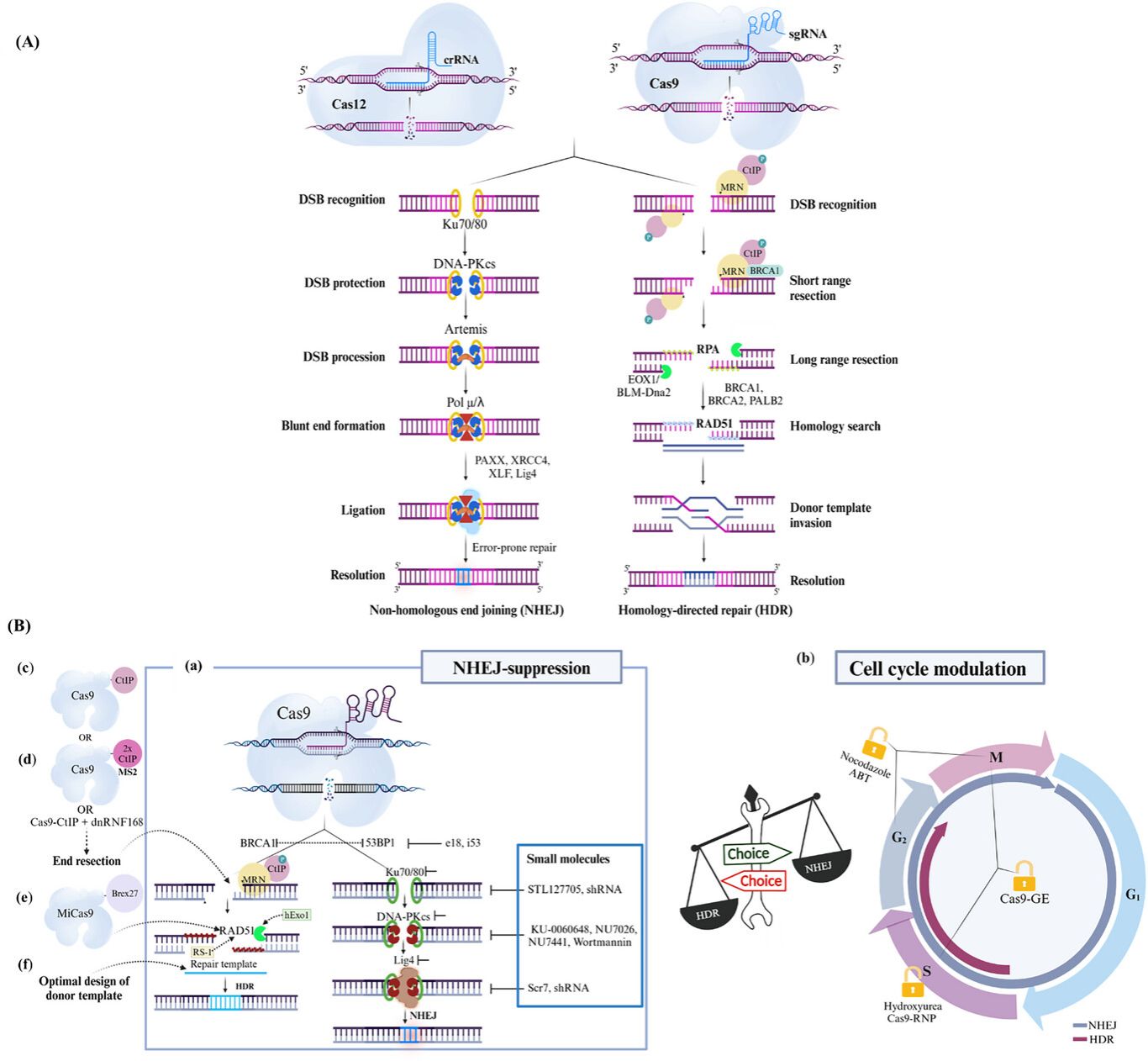
图2 CRISPR诱导双链断裂(DSBs)后,非同源末端连接(NHEJ)与同源定向修复(HDR)之间的DNA修复途径选择。(A) 非同源末端连接(NHEJ) 是一种易出错的修复机制,由Ku70/80和DNA-PKcs启动,导致末端保护和由Lig4介导的连接,通常产生插入/缺失(indels)。相比之下,同源定向修复(HDR) 依赖于MRN复合体以及Exo1/DNA2-BLM进行的末端切除,随后是RAD51介导的、利用同源模板进行的链侵入,从而实现精确修复。(B) 使修复偏向HDR的策略包括:(a) 抑制NHEJ(例如,靶向53BP1或DNA-PKcs);(b) 将细胞同步在S/G2期; (c-f) 通过Cas9融合蛋白(例如,融合CtIP、BRCA2功能域)增强切除,以及优化供体DNA设计。这些方法旨在提高基因组编辑的精确性。
二、递送系统安全升级
病毒载体(如AAV)虽能长效编辑,但存在免疫激活、插入突变风险,化学载体可能具遗传毒性。团队提出分层解决方案:载体优化:采用瞬时表达的RNP复合物(替代质粒DNA),降低脱靶效应;尺寸精简:选用超紧凑Cas酶(如Cas12f<2kb)或拆分Cas9系统,突破AAV装载限制;靶向增效:工程化AAV变体(如AAV7/8)实现组织特异性递送,脂质纳米颗粒(LNP)联合细胞穿膜肽(CPP)增强细胞核定位。
三、突破PAM限制
传统SpCas9受限于NGG-PAM序列。团队通过酶工具革新:改造SpCas9变体(如SpRY)识别任意PAM; 挖掘新核酸酶:ScCas9(NNG-PAM)、LrCas9(NGAAA-PAM); 引入V型系统:Cas12a(TTTV-PAM)、Cas14(无需PAM)。此外,编辑策略升级,引导编辑(PE)技术将编辑范围拓展至切割位点30bp外。
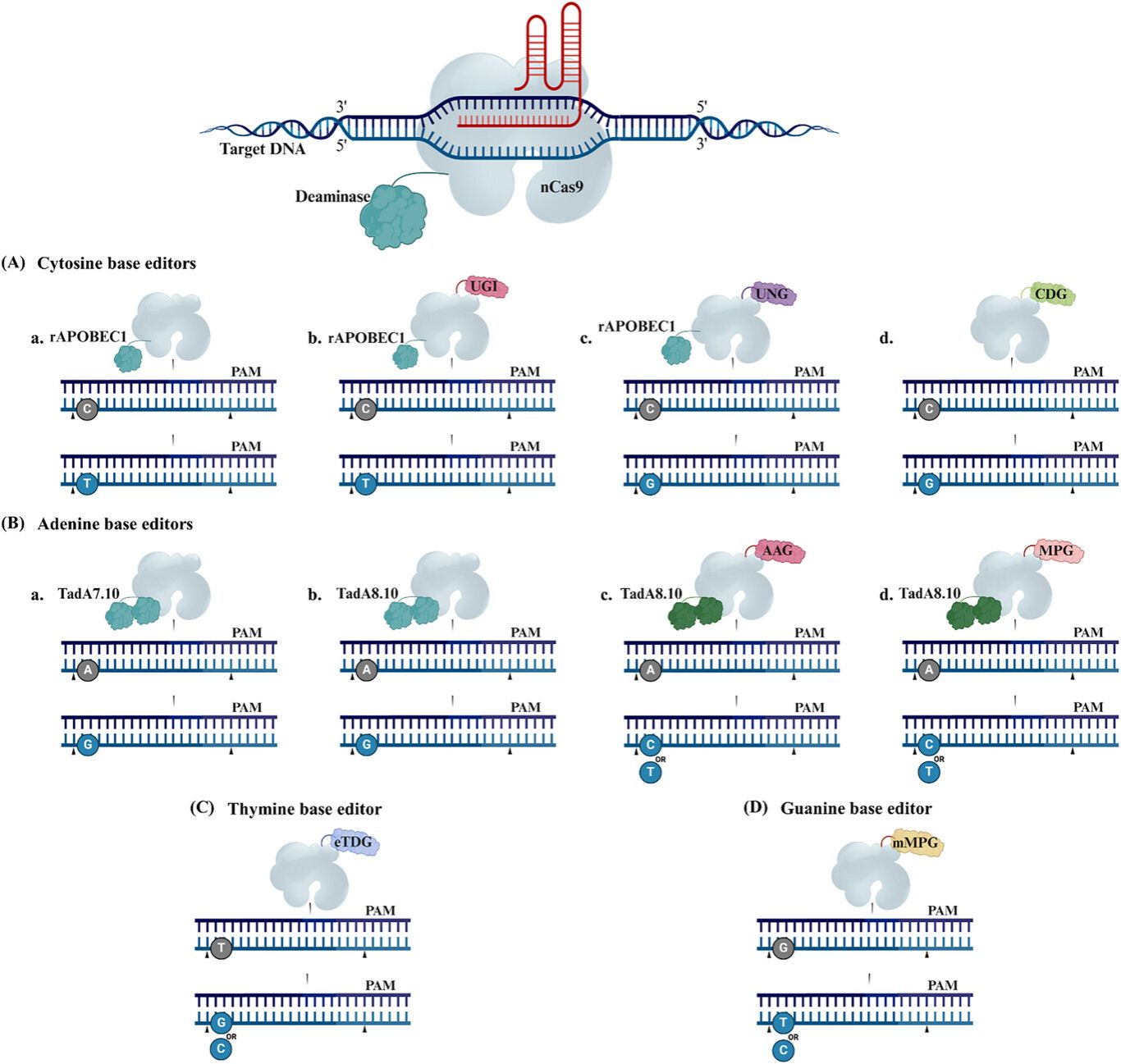
图3 CRISPR碱基编辑器的机制,这些编辑器可在不诱导双链断裂的情况下实现精确的单核苷酸编辑。(A) 胞嘧啶碱基编辑器 (CBEs):使用与胞嘧啶脱氨酶(例如 rAPOBEC1)融合的切口酶Cas9 (nCas9),将 C 转化为 T;其中,尿嘧啶糖基化酶抑制剂 (UGI) 可增强编辑效率,而融合尿嘧啶-DNA糖基化酶 (UNG) 或胞嘧啶脱氨酶与DNA糖基化酶 (CDG) 则能实现 C→G 编辑。(B) 腺嘌呤碱基编辑器 (ABEs):利用工程化的TadA变体(例如 TadA7.10 或 TadA8e)实现 A→G 转换;而与糖基化酶(如 AAG 或 MPG)融合则可扩展编辑范围,实现 A→C 或 A→T 编辑。(C) 胸腺嘧啶编辑器 和 (D) 鸟嘌呤编辑器:分别利用直接与 nCas9 融合的糖基化酶(如 UNG 或 MPG)来实现 T→G/C 或 G→T/C 的碱基替换——所有这些系统均无需外源的脱氨酶。总的来说,这些系统拓宽了可编程碱基编辑的应用范围。
四、无切割编辑新范式
规避传统DSB导致的染色体异常风险的精准改写:碱基编辑(BE):DAF-CBE无脱氨酶设计实现C→T转换;RNA编辑:dCas13-ADAR2系统精准修正转录本(A→I);大片段整合:TwinPE双引物编辑+丝氨酸重组酶,实现11kb DNA定点插;PASTE技术整合逆转录酶与大片段整合酶,承载36kb基因载荷。
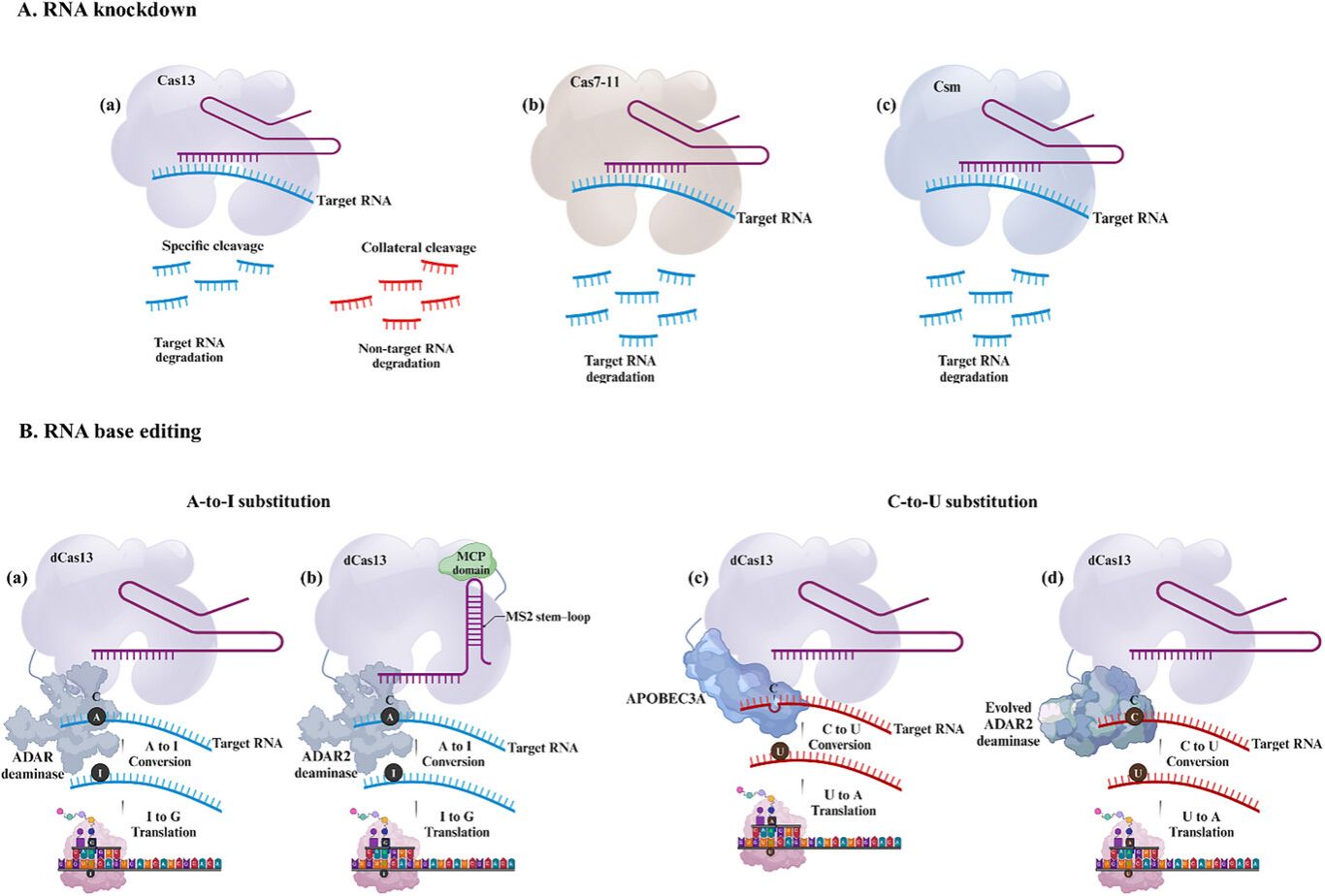
图7 展示了CRISPR介导的RNA靶向技术,用于RNA敲降和精确碱基编辑。(A) RNA敲降系统:(a) Cas13 切割靶标单链RNA,并具有附带切割活性,(b) Cas7-11 能够实现精确的RNA降解,且无附带效应,(c) 多亚基Csm复合物 执行可编程的RNA切割。(B) RNA碱基编辑:(a-b) 基于ADAR的系统(使用dCas13或MS2-MCP进行招募)可实现A→I(腺苷到肌苷)编辑;(c-d) RESCUE(基于进化的ADAR2)和CURE(基于APOBEC3A突变体)系统则通过靶向胞嘧啶脱氨作用实现C→U(胞苷到尿苷)转换。这些工具将CRISPR的应用扩展到了转录组工程领域,且不产生永久性的基因组改变。
五、未来展望:AI驱动的精准编辑时代
CRISPR技术虽已革新基因工程,但仍面临特异性、精准性、递送效率和安全性的挑战。未来突破需范式转变:1) AI深度赋能:利用机器学习(如DeepCRISPR)预测脱靶、优化设计,实现个性化编辑方案;2) 递送系统革命:开发智能载体(如组织靶向AAV、高效逃逸LNP)、瞬时控释系统(光降解RNP)及超大装载方案(混合载体、超紧凑Cas酶),攻克递送难关;3) 无切割编辑崛起:发展小型化碱基/引物编辑器(如TadA-8e融合体)、大片段整合技术(如TwinPE)及多组学调控工具(Cas13-ADAR、表观编辑器),规避染色体断裂风险;4) 伦理与监管并重:亟需建立全球性框架,严格规范种系编辑及农业应用。通过融合AI、递送创新与无切割工具,CRISPR将开启治愈遗传病、培育气候韧性作物等精准分子设计的新纪元。
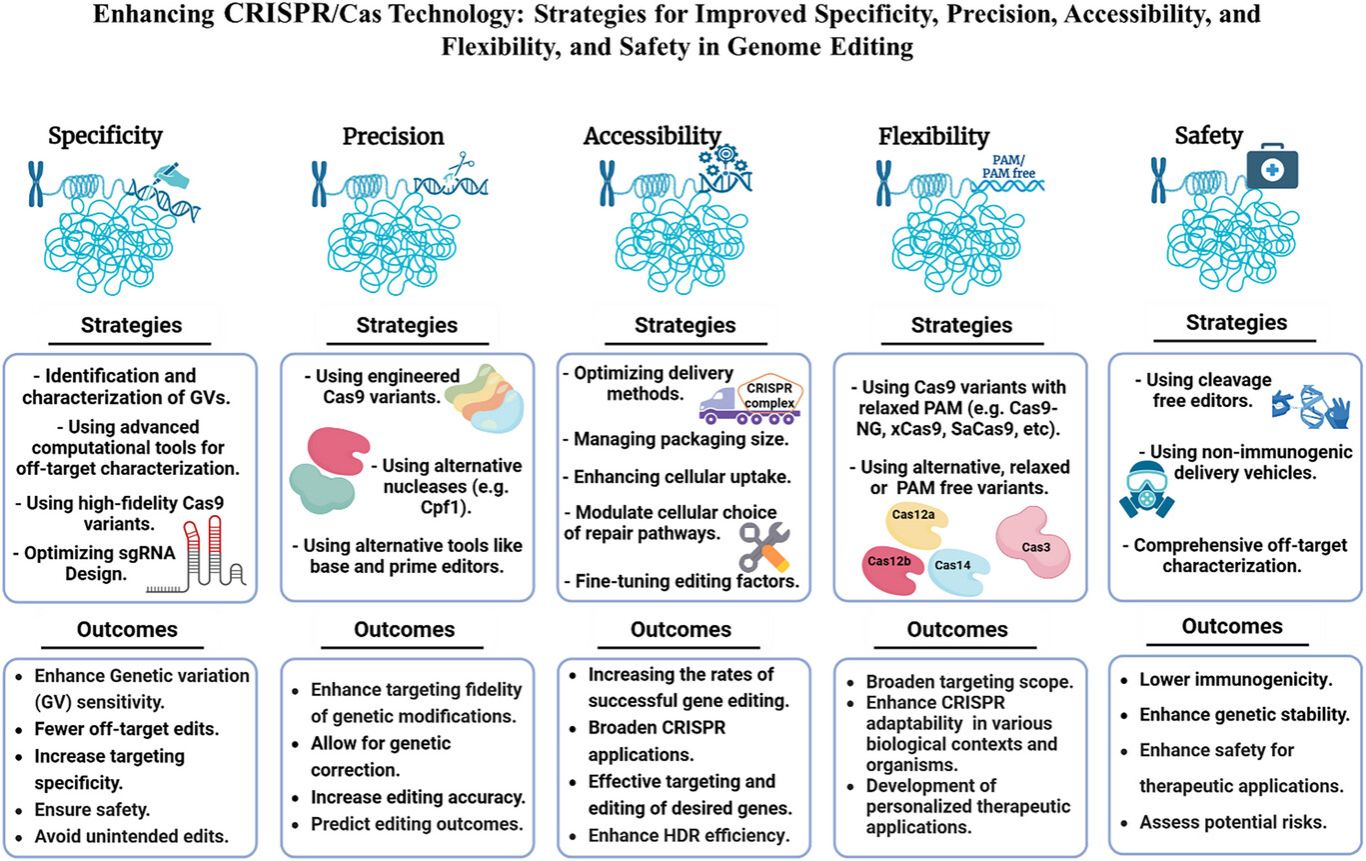
图8优化CRISPR/Cas技术的五大关键领域战略进展:特异性 (Specificity):高保真Cas9变体、考虑遗传变异(GV)的sgRNA设计,以及计算脱靶预测;精确性 (Precision):工程化核酸酶、用于单核苷酸编辑的碱基编辑器/先导编辑器;可操作性 (Accessibility):改进的递送系统、紧凑型包装(如AAV递送),以及增强同源定向修复(HDR);灵活性 (Flexibility):无PAM限制的Cas变体(如Cas12b/Cas3),实现更广泛的靶向;安全性 (Safety):非免疫原性递送、严格的脱靶筛选,以及治疗风险管控。总而言之,这些创新旨在最大化CRISPR的效能,同时最小化其在多样化应用场景中的脱靶效应。
金双侠课题组前期已开发了Cas9, Cas12a, Cas12b, CBE, ABE, ABE8e, dCas9-TV, TDE,TME等工具,能够在靶标位点进行敲除、敲入、敲高、敲低、SNP点突变等精准修饰,并利用这些工具创制了棉籽无棉酚、高油酸、除草剂抗性、抗虫、彩色棉花等优异新种质,为棉花功能基因组研究和分子设计育种提供了完备的工具箱和技术体系。( Zhang et al., 2018, PBJ, Li et al., 2019, PBJ; Wang et al., 2020, PBJ; Qin et al., 2020, PBJ; Li et al., 2020, PBJ; Hakim et al., 2020, Advanced Science; Wang et al., 2022, BMC Biology; Yu et al., 2023, Plant Communications; Sun et al., 2023, Advanced Science; Wang et al., 2024, Genome Biology; Hui et al., 2024, iMeta; Wang et al., 2024, Plant Communications;Yu et al., 2024, Advanced Sciences;Yu et al., 2024, Genome Biology)。
性爱网
博士后Muna Alariq为本论文第一作者,性爱网
金双侠教授、张献龙院士、新疆农垦科性爱网棉花研究所余渝研究员与周小凤研究员为论文的共同通讯作者。中国科性爱网武汉植物园博士生Mohaed Ramadan、性爱网
博士后余露、博士生惠凤娇、博士生Amjad Hussain参与了该项研究工作。该研究得到了国家自然科学基金杰出青年科学基金、国家自然科学基金和生物育种重大专项等项目的资助。
原文链接:
//advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202416331


